Os produtos estéreis são desenvolvidos para a limpeza ambientes controlados de forma eficiente, sem comprometer a natureza dos ambientes controlados.
Embora produtos estéreis como wipers (panos para sala limpa) não sejam dispositivos médicos, os fabricantes como a Texwipe optam por seguir as diretrizes da Association for the Advancement of Medical Instrumentation® (AAMI) sobre a validação da esterilização por radiação e os requisitos da Farmacopeia dos Estados Unidos para testes de endotoxina.
Produtos Estéreis: Esterilização, validação e documentação
Os panos para sala limpa normalmente são esterilizados por irradiação gama, feixe de elétrons ou autoclavagem a vapor. A fabricante Texwipe escolheu a irradiação gama em vez de outras técnicas de esterilização pelas seguintes razões:
- A irradiação gama tem mais poder de penetração do que o feixe de elétrons;
- A irradiação gama é um processo relativamente fácil de validar. Isto é muito importante porque os produtos esterilizados devem cumprir as normas AAMI;
- A radiação gama não deixa resíduos do tratamento;
- A radiação gama é compatível com muitos dos materiais e soluções usados nos produtos da Texwipe;
- A irradiação gama demonstrou reduzir os níveis de endotoxinas em maior extensão do que a irradiação por feixe de elétrons.
Endotoxinas bacterianas, ou pirogênios, são materiais causadores de febre das membranas celulares externas de bactérias Gram-negativas. A autoclavagem a vapor não reduz os níveis de endotoxinas.
Comparação das técnicas de irradiação gama e elétron para esterilização
| Incluir | Gamma (fonte de cobalto-60) | Feixe de elétron |
| Penetração | Maior | Menos (dependente de energia) |
| Uniformidade de Campo | Mais uniforme | Menos uniforme |
| Uniformidade de dose | Mais uniforme | Menos uniforme |
| Taxa de dose | Mais devagar | Mais rápido |
| Experiência | Mais | Menos |
| Esterilização | Igual | Igual |
| Validação | Mais simples | Mais complexo |
| Despirogenação | Melhor | Pior |
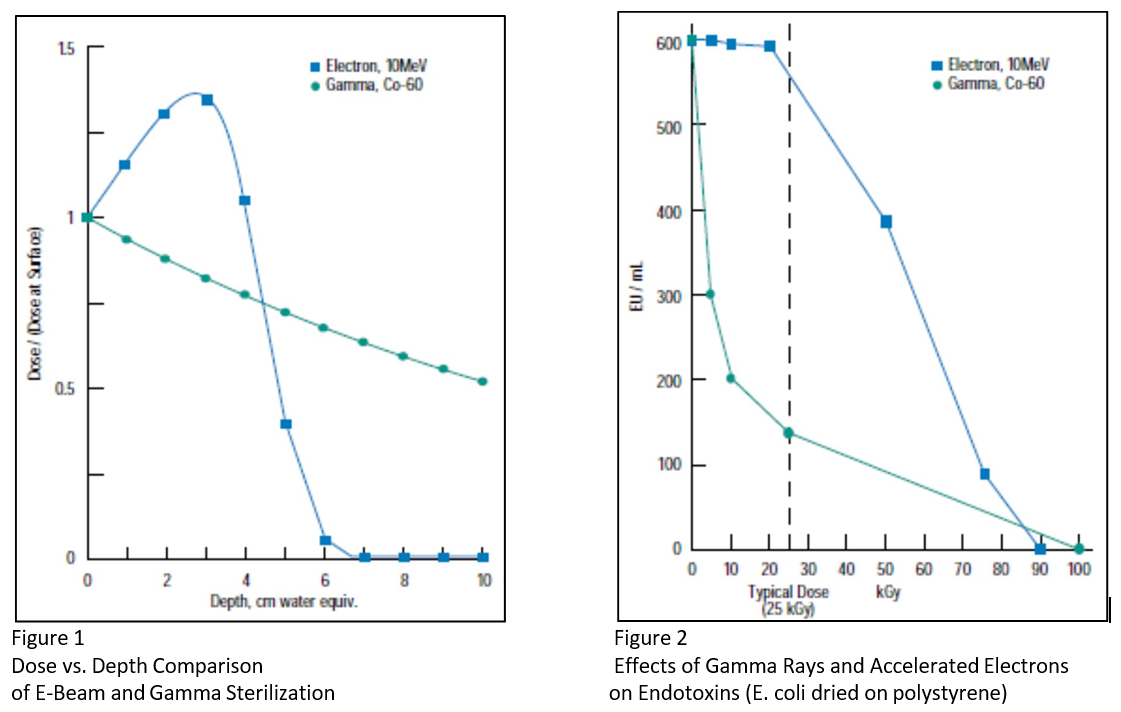
Na imagem abaixo vemos no gráfico 1 a comparação entre a dose normalizada versus profundidade para um produto irradiado por feixe de elétrons em energia de 10MeV com outro irradiado por raios gama de uma fonte de cobalto-60. Este gráfico ilustra a penetração mais limitada do feixe de elétrons e é válido para a maioria dos plásticos e objetos com a densidade da água. Os feixes de elétrons penetram apenas cerca de 6 cm de água e com a mesma profundidade em soluções de álcool isopropílico 70% / água 30%, uma vez que as densidades são quase as mesmas. A dose de irradiação gama é 60% da dose de superfície na profundidade onde a dose do feixe de elétrons é virtualmente zero.
O gráfico 2 (ao lado) quantifica a redução dos níveis de endotoxina. Na dose de irradiação típica de 25 kGy, os níveis de e. A endotoxina coli, medida por Guyomard e cols. 2 , foi reduzida em quase 80% quando irradiada por raios gama e apenas 10% quando irradiada por feixe de elétrons.
Visão geral do processo de validação
Uma vez que os produtos estéreis Texwipe são esterilizados de acordo com as diretrizes da AAMI para a validação da esterilização por radiação, um regime de processamento rígido é seguido. Os panos para sala limpa são testados com bio carga e os dados são corrigidos para recuperação. Uma validação de subdose é realizada para garantir que não haja cepas bacterianas resistentes à radiação presentes. Uma vez alcançada a validação da dose do subprocesso, os produtos são irradiados com gama na dose determinada pela carga biológica e confirmada pela validação da dose do subprocesso. Todo produto irradiado recebe um Certificado de Processamento.
Teste de Pirogênio
Endotoxinas bacterianas, ou pirogênios, são materiais causadores de febre das membranas celulares externas das bactérias Gram-negativas. A maioria das bactérias na água limpa são Gram-negativas. Quando a bactéria morre, a endotoxina é liberada na água. Um exemplo de bactéria Gram-negativa com a qual todos estamos familiarizados é a e.coli, frequentemente encontrada em água contaminada. Níveis diminutos dessas toxinas bacterianas estão associados a certas doenças bacterianas e à produção de febre, choque anafilático e morte em humanos e animais.
Remover os pirogênios de amostras contaminadas é extremamente difícil. As técnicas de esterilização matam os organismos vivos e, como os pirogênios vêm de células mortas, as técnicas de esterilização padrão, com poucas exceções, não são eficazes na redução dos níveis de pirogênios. A prevenção da contaminação bacteriana é o melhor ação a ser tomada para garantir produtos de alta qualidade. Portanto, é essencial garantir que os materiais usados durante a produção do medicamento parenteral ou dispositivo médico não contribuam para os níveis de pirogênio.
Os limites permitidos de endotoxinas em medicamentos parenterais humanos e animais, produtos biológicos e dispositivos médicos nos estados Unidos são estabelecidos pelo FDA. Texwipe SterileWipes e Sterile Flexpacks estão em conformidade com os requisitos da Farmacopeia dos Estados Unidos. Este limite, aplicado a dispositivos em contato, direta ou indiretamente, com o sistema cardiovascular ou sistema linfático, foi estabelecido em menos de 20 unidades / dispositivo de endotoxina ( <20 EU / dispositivo).
Método de teste
O método de ensaio amplamente utilizado para endotoxinas bacterianas é baseado no extrato de células sanguíneas, ou amebócitos, do caranguejo-ferradura (Limulus polyphemus). Assim como um ser humano doa sangue, o caranguejo-ferradura “doa” parte de seu sangue, que é dividido em seus componentes, plasma e amebócitos. O LAL (lisado de amebócito Limulus) é produzido pela lise (ruptura) desses amebócitos, e o reagente LAL é uma mistura de proteínas e sais cuja origem é o amebócito. O teste LAL é uma medida eficaz dos níveis de endotoxina, pois é extremamente sensível. O teste de coágulo de gel típico é capaz de detectar níveis de endotoxina tão baixos quanto 0,03EU / mL (cerca de 0,003 ng / mL ou 0,003 partes por bilhão).
Conforme descrito na USP 23, o método de teste inclui as seguintes etapas:
- Entre três e dez wipers são extraídos com Água de Qualidade LAL (Água USP para Injeção);
- Um reagente LAL padronizado é misturado com as amostras de teste e aquecido;
- Um gel firme é formado se a concentração de endotoxina exceder a sensibilidade do reagente marcado.
Além disso, um ensaio de validação é realizado da seguinte maneira:
- O reagente é testado contra um padrão de endotoxina, com diluições em série;
- Os extratos são testados para garantir que não inibam ou aumentem a formação do gel na presença de endotoxinas;
- Este ensaio de validação é realizado em quadruplicado.
Resultado dos testes
Embora os panos para sala limpa não sejam considerados dispositivos médicos e não sejam obrigados a estar em conformidade com os padrões USP 23, os resultados do teste mostrados na tabela abaixo indicam que os produtos estéreis da Texwipe atendem a um padrão de <20 unidades de endotoxina / wiper.
Resultados do teste de endotoxina para limpadores
| Nome do Produto | Substrato | Nível de endotoxina |
| SterileWipe HSII (TX3210) | Mistura de poliéster-celulose | <20 EU / limpador |
| SterileWipe LP (TX3211) | Poliéster | <20 EU / limpador |
| SterileWipe LP10 (TX3212) | Poliéster selado | <20 EU / limpador |
| PolySat estéril (TX3213) | Polipropileno pré-umedecido com 70% IPA / 30% DIW | <20 EU / limpador |
| TechniSat estéril (TX3214) | Mistura de poliéster-celulose pré-umedecida com 70% IPA / 30% DIW | <20 EU / limpador |
| Esterilização AS 10 (TX3215) | Poliéster selado | <20 EU / limpador |
| PolySat estéril (TX3216) | Polipropileno pré-umedecido com | <20 EU / limpador |
EU = unidade de endotoxina
IPA = álcool isopropílico, DIW = água desionizada
Conclusão
Os limpadores estéreis Texwipe são irradiados a uma probabilidade de não esterilidade (também chamada de nível de garantia de esterilidade) de 10-6 de acordo com os padrões AAMI e são testados para níveis de pirogênio por USP 23. Isso garante a mais alta qualidade de produtos de limpeza disponíveis para limpeza e desinfecção de equipamentos e superfícies ambientais em condições estéreis. Esses produtos são ideais para limpar áreas de envase de produtos farmacêuticos assépticos, suítes estéreis, salas de preparação, laboratórios microbiológicos e instalações de fabricação de biotecnologia.