O eletrodo de íon é o eletrodo que responde a íons específicos em uma solução aquosa, exemplo: o eletrodo de vidro sensível ao pH é um eletrodo de íon de hidrogênio. No entanto, o termo “eletrodo de íon”, embora se refira a um eletrodo que responde a um tipo específico de íon, geralmente exclui o caso especial do eletrodo de vidro sensível ao pH.
A pesquisa sobre eletrodos de íons tem sido ativamente desenvolvida desde a década de 1960. Desde um estágio inicial, a HORIBA também desenvolveu e colocou à venda vários tipos de eletrodos iônicos.
Para medir a concentração de íons de um íon específico, um medidor de íon – ou um medidor de pH capaz de medir íons – é conectado ao eletrodo de íon específico relevante e um eletrodo de referência, e estes são imersos na solução de teste. A concentração específica de íons na solução de teste é obtida medindo-se a força eletromotriz entre os dois eletrodos. Para compensar a sensibilidade (ou seja, para determinar a curva de calibração), este método requer dois tipos de soluções de referência com diferentes concentrações do íon específico. Assim como com o eletrodo de vidro sensível ao pH, a sensibilidade dos eletrodos de íons também é afetada pela diferença de temperatura, então a medição deve ser realizada em uma única temperatura constante (25 ° C, por exemplo).
Um eletrodo de íon responde não apenas ao íon específico de interesse, mas também a outros íons que têm características semelhantes àquelas desse íon. O coeficiente de seletividade é uma medida desse efeito, ou seja, aquele pelo qual um eletrodo responde a tipos de íons diferentes do tipo de interesse.
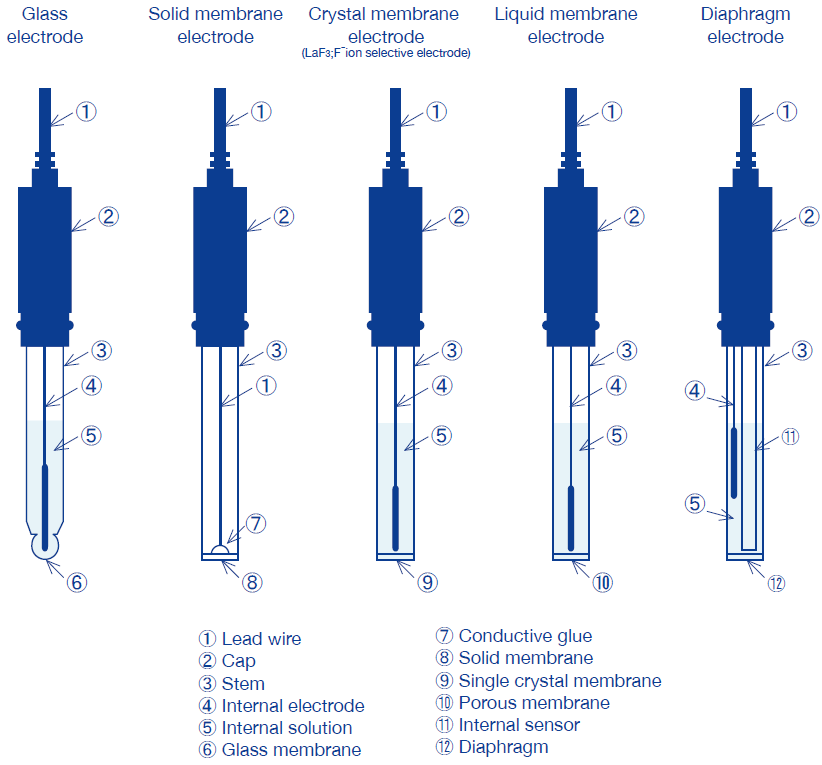
As membranas de resposta para eletrodos de íons incluem membranas de vidro (para eletrodos de Na +), membranas de estado sólido à base de sal de prata (para os correspondentes CN-, Cl-, S2-, I-, Br-, SCN-, Cu2 +, Cd2 +, Pb2 +, ou Eletrodo Ag +), membranas de cristal único (para eletrodos F-), membranas líquidas e membranas de solidificação de plástico (para eletrodos No3-, K +, Na + e Ca2 +) e diafragma (para eletrodos de amônia).
Aplicações de eletrodos de íons
(1) Medição do potássio contido em vários alimentos
O teor de potássio de 15 tipos de alimentos foi medido usando um fotômetro de chama e um eletrodo de íon potássio. O diagrama abaixo mostra uma comparação entre esses dois métodos. *
Na figura, o eixo horizontal representa as medições usando o fotômetro de chama e o eixo vertical representa as medições com o eletrodo de potássio. Eles mostram um alto nível de concordância (coeficiente de correlação r = 0,99, n = 15). Esses valores indicam a quantidade de potássio em mg contida em 100 g de amostra.
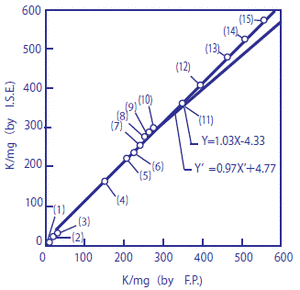
Figura 1 Medidas da quantidade de potássio contido nos alimentos
eixo X: Fotômetro de chama; Eixo Y: eletrodo de íon potássio
A quantidade de potássio contida nos seguintes 15 tipos de alimentos e bebidas foi medida: (1) suco de uva, (2) bebida de íon alcalino, (3) bebida esportiva, (4) leite, (5) suco de tomate, (6) pepino, (7) presunto, (8) batata, (9) repolho, (10) molho inglês, (11) banana, (12) molho de soja, (13) ketchup de tomate, (14) salsa e (15) soja colar. As medições diretas foram realizadas nas amostras (1), (2), (3) e (4) após o ajuste do pH, sem serem diluídas. Antes de realizar a medição, cerca de 1 g de cada uma das amostras (5) a (15) foi diluído 100 vezes. Entre estes, as amostras (5), (7), (10), (12), (13) e (15) tiveram o pH ajustado, e ácido clorídrico foi adicionado às amostras diluídas (6), (8), ( 9), (11) e (14), fazendo soluções de ácido clorídrico a 1% que foram então neutralizadas com hidróxido de sódio.
As amostras de alimentos sólidos foram completamente trituradas usando uma argamassa de ágata antes da realização dos tratamentos descritos acima.
* T. Miyazaki e T. Aomi, “Determinação do teor de potássio dos alimentos usando um eletrodo seletivo de íons de potássio”, Electrochemistry, vol.52 (8), pp.521-523, 1984
Em resposta aos requisitos da época, muitos tipos de eletrodos de íons foram usados como detectores em medidores de íons específicos dedicados. Os seguintes são exemplos:
- T. Miyazaki e T. Aomi, “medidor de sal para alimentos usando um eletrodo seletivo de íons de sódio,” Electrochemistry, vol.49 (10), pp.657-659, 1981
- “Medidor de sal para agregado de concreto pré-misturado (areia do mar) usando um eletrodo seletivo de íon cloreto,” Medição de sal em concreto para avaliação de tecnologia: No. 860402, Japan Institute of Construction Engineering; requerente: Horiba, Ltd .; 1986
- A literatura a seguir refere-se à medição da concentração de íons eletrolíticos no sangue usando eletrodos de íon sódio, íon potássio e íon cloreto:H. Nose, E. Sugimoto, T. Morimoto, S. Usui e T. Aomi, Jpn. J. Phy. 36. 607–611, 1986
H. Uematsu, T. Kono, S. Usui e T. Aomi, Electrochemistry, vol.55 (7), pp.532–535, 1987
“Potassium and sodium ion analiser ,” Patente do Japão anúncio de registro nº 1982-32771 (Cessionário: Horiba Ltd .; Inventores: Kenji Yoshino e Takashi Aomi; Solicitado em 1976)
Eletrodos seletivos de íons são estipulados em JIS K 0122: Regras gerais sobre métodos de eletrodos seletivos de íons. (Confirmado em 2006)
(2) Medição do teor de sal em alimentos processados usando um eletrodo de vidro seletivo de íon de sódio
As duas figuras a seguir comparam o teor de sal (equivalentes de sal) em alimentos processados medidos usando um eletrodo de vidro seletivo de íons de sódio com aqueles medidos pelo método de titulação (método de Mohr) e fotometria de chama de sódio.
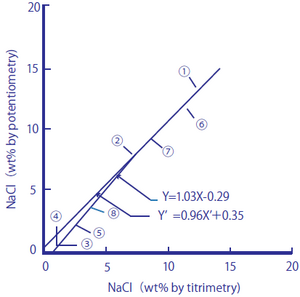
Figura 2-1: Comparação entre o teor de sal em alimentos processados medido pelo método de titulação e o método de eletrodo de íon de sódio
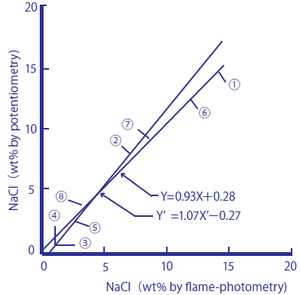
Figura 2-2: Comparação entre o teor de sal em alimentos processados medido por fotometria de chama e o método de eletrodo de íon de sódio
Os alimentos processados usados foram ① molho de soja, ② molho inglês, ③ suco de tomate, ④ suco de vegetais, ⑤ o líquido de flocos de atum enlatado, ⑥ missô, ⑦ ovas de bacalhau e ⑧ ketchup de tomate. Como amostras, 1,00 cm3 de ① e ②, 10,0 cm3 de ③, ④ e ⑤, e 1,00 g de ⑥, ⑦ e ⑧ foram tomados, e água pura foi adicionada a eles até que as quantidades totais das soluções de amostra atingissem 100 cm3. Os valores de medição são mostrados em porcentagem por peso (% em peso).
Figura 2-1 Linha de regressão
y = 1,03X-0,29 ey ‘= 0,96 X’ + 0,35 obtido
O coeficiente de correlação é y = 0,99 (n = 8)
Figura 2-2
y = 0,93X + 0,28 ey ‘= 1,07 X’- 0,27 obtido
y = 0,99 (n = 8)
Esses alimentos processados contêm glutamato monossódico e outras substâncias que produzem íons de sódio, além do sal. Os resultados de medição obtidos pelo método de titulação, que mede íons cloreto, concordam bem com aqueles obtidos pelo método de eletrodo de vidro seletivo de íon de sódio, e assume-se que muitos dos íons de sódio contidos nos alimentos processados vêm do sal na faixa de medição . Os resultados das medições obtidos pelo método da fotometria de chama de sódio concordam bem com os obtidos pelo método do eletrodo de vidro seletivo de íons de sódio, e assume-se que os alimentos processados possuem baixo teor de íons de potássio, o que afeta as medições com um eletrodo de vidro seletivo de íons de sódio.
* Takashi Aomi e Takeshi Miyazaki, “Electrochemistry”, 49 (10), pp. 657 a 659 (1981)
(3) Monitoramento de pequenas quantidades de íons de sódio na água da caldeira em usinas térmicas e nucleares
Como uma aplicação industrial de eletrodos de íons, explicaremos sobre o monitoramento de pequenas quantidades de íons de sódio.
O vapor aciona as turbinas de geração de energia em usinas térmicas e nucleares. O vapor é então resfriado por água externa (principalmente água do mar) por meio de trocadores de calor e, eventualmente, condensando para se tornar água da caldeira novamente.
Se ocorressem furos no trocador de calor, isso resultaria em uma pequena quantidade de água do mar entrando na água da caldeira. Um monitor de íon de sódio de quantidade minuto com um eletrodo de Na + como detector é usado para observar isso.
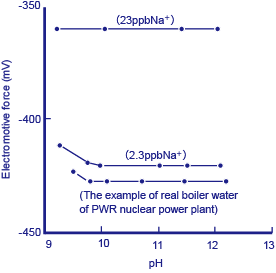
Figura 3 Exemplo de medição de uma solução de referência e água da caldeira real usando um monitor de íon de sódio de quantidade minuto
Soluções de referência de 10 -6 M (23 ppb Na + ) e 10 -7 M (2,3 ppb Na + ), junto com a água da caldeira real foram medidas usando um monitor de íon de sódio de quantidade minuto. O diagrama acima * mostra os resultados. Antes de realizar a medição, uma solução de amina foi adicionada às soluções de referência e de amostra para torná-las fortemente alcalinas como uma proteção contra a obstrução por íons de hidrogênio. Embora cerca de 0,6 ppb de Na + foi detectado na água da caldeira real, uma vez que é difícil preparar soluções de referência corretamente neste nível de concentração, este valor não pode ser reivindicado como sendo exato. No entanto, mesmo uma pequena quantidade de água do mar entrando na água da caldeira causa uma mudança repentina neste valor e imediatamente aciona um alarme de advertência indicando que furos de pino podem ter se desenvolvido no trocador de calor (resfriador).
* “Sistema de medição de concentração de íons de sódio”, pedido de modelo de utilidade japonês e anúncio de registro nº: 1990-10456 (Cessionário: Horiba Ltd .; Inventores: Shigeyuki Akiyama e Takashi Aomi; Solicitado em 1982)
(4) Medição de íons de flúor em soluções de corrosão semicondutor tratadas com efluentes
As soluções de corrosão semicondutor contêm ácido fluorídrico. Depois de serem tratados com efluentes pela adição de hidróxido de cálcio, eles são medidos quanto ao conteúdo de íons de flúor e então reutilizados na fábrica. (Em geral, as fábricas de semicondutores empregam um sistema fechado que evita a descarga externa de água residual.)
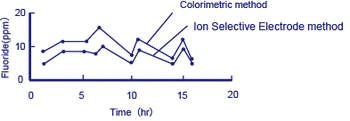
Figura 4 Exemplo de medição de fluoretos na água de processamento
Isto acima mostra o diagrama de um exemplo de medições obtidas usando o método colorimétrico, e com um íon método fluoreto seletiva eléctrodo equipado com um F – . Eléctrodo atua como o detector *
As medidas método colorimétrico flúor átomos no estado ligado (por exemplo, F em CaF 2 ) por destilação de uma solução de teste, enquanto o método do eletrodo seletivo de íons detecta apenas F – livre . Embora as medições dos dois métodos sejam diferentes (o método colorimétrico mostra concentrações mais altas), a tendência que eles seguem concorda bem.
No tratamento de efluentes de soluções que contêm fluoretos, o CaF 2 precipitado é removido, por isso é importante detectar a concentração de íons F – livres.
* T. Aomi, “Eletrodos e aplicações seletivas de íons”, JSR, No.3, pp.14-21, 1981
Categorização de eletrodos de íons por membrana de resposta
Os eletrodos seletivos de íons são classificados nos cinco tipos mostrados abaixo, dependendo da membrana de resposta.
Os eletrodos têm uma resistência interna diferente dependendo de sua membrana de resposta e também requerem diferentes métodos de medição, armazenamento do eletrodo e manutenção do eletrodo.